L’autophagie, également appelée « autolyse » ou « autophagocytose », vient du grec « se manger soi-même ». Il s’agit d’un mécanisme naturel qui consiste en la dégradation partielle du contenu cellulaire par la cellule elle-même, son nettoyage et son recyclage. Ce phénomène est connu depuis les années 1960 grâce au médecin et biochimiste Christian de Duve. Néanmoins, le professeur Yoshinori Ohsumi a reçu le prix Nobel de médecine et de physiologie en 2016 pour ses découvertes sur les mécanismes de l’autophagie.
Cet article technique, mais indispensable pour comprendre les bienfaits de l’autophagie, s’adresse aux plus curieux. Nous avons essayé de le rendre aussi explicite que possible afin que vous puissiez comprendre tous les mécanismes de ce précieux phénomène : l’autophagie.
Bref préambule
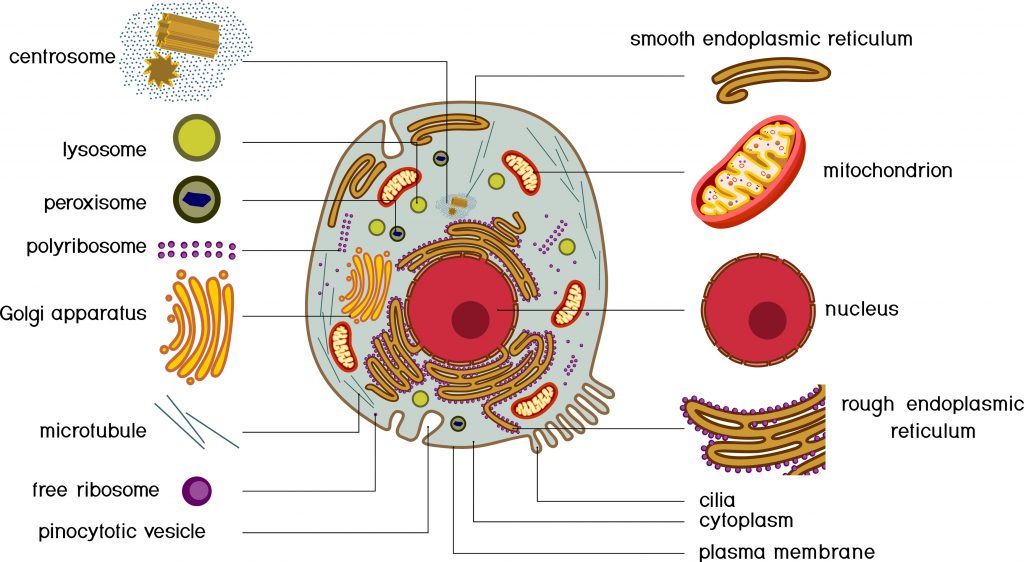
Cytoplasme : désigne l’ensemble de l’espace situé entre le noyau et la membrane plasmique. Il est constitué de cytosols et d’organites.
Cytosol : Fraction semi-liquide du cytoplasme.
Organite cellulaire : structure spécialisée contenue dans le cytoplasme et délimitée du reste de la cellule par une membrane phospholipidique. Les cellules eucaryotes abritent de nombreux organismes, dont les principaux sont : le noyau, le réticulum endoplasmique, l’appareil de Golgi, les mitochondries, les lysosomes, les peroxysomes, etc.
Noyau : Organite cellulaire qui contient la majeure partie du matériel génétique de la cellule, ainsi que la machinerie nécessaire à la réplication des chromosomes et à l’expression de l’information contenue dans les gènes. Il est entouré d’une double membrane appelée enveloppe nucléaire.
Lysosome : Organite cellulaire présent dans le cytosol dont la fonction est de réaliser la digestion intracellulaire grâce à une quarantaine d’enzymes.
Ribosome : organite cellulaire qui synthétise les protéines qui composent chacune de nos cellules en décodant les informations contenues dans l’ARN messager.
Qu'est-ce que l'autophagie ?
L’autophagie est un processus d‘autodégradation des composants cellulaires destiné à réguler diverses fonctions cellulaires. Ces fonctions sont : la croissance, la différenciation, la réponse à la famine ou au stress oxydatif, la mort cellulaire programmée et le renouvellement des composants intracellulaires endommagés. De plus, elle joue un rôle dans le maintien et le nettoyage des organites endommagés, des protéines mal repliées ou agrégées et des pathogènes invasifs à l’intérieur de la cellule.
L’autophagie est également un mécanisme de recyclage. En effet, les sous-produits de la dégradation seront réutilisés pour produire de nouveaux éléments constitutifs et de l’énergie. Ainsi, en réponse à une privation de nutriments, d’acides aminés, de facteurs de croissance ou d’oxygène, l’autophagie est induite pour fournir une autre source d’énergie aux cellules à partir du matériel cellulaire recyclé afin de les aider à survivre. Elle est donc considérée comme un élément clé de la réponse adaptative des cellules et des organismes au stress. En effet, elle favorise la survie jusqu’à ce que les nutriments soient à nouveau disponibles. De plus, elle contribue à maintenir l’intégrité de la cellule en la renouvelant et en assurant l’homéostasie en général.
Caractéristiques et mécanismes moléculaires
Historiquement, l’autophagie était considérée comme un processus non sélectif de dégradation de certaines parties du cytoplasme en cas de famine ou de faible niveau d’énergie au sein de la cellule, afin de favoriser la survie cellulaire par le recyclage du matériel cytoplasmique. Mais de plus en plus de preuves suggèrent que l’autophagie sélective dégrade les organites endommagés, les protéines agrégées et les micro-organismes pathogènes. Ce processus est assuré par différentes protéines appelées ATG (Autophagy-Related Gene).
Il existe trois types d’autophagie :
- la macro-autophagie
- la micro-autophagie
- l’autophagie médiée par des protéines chaperonnes (CMA)
Lorsqu’on parle d’autophagie, on fait généralement référence à la macro-autophagie.
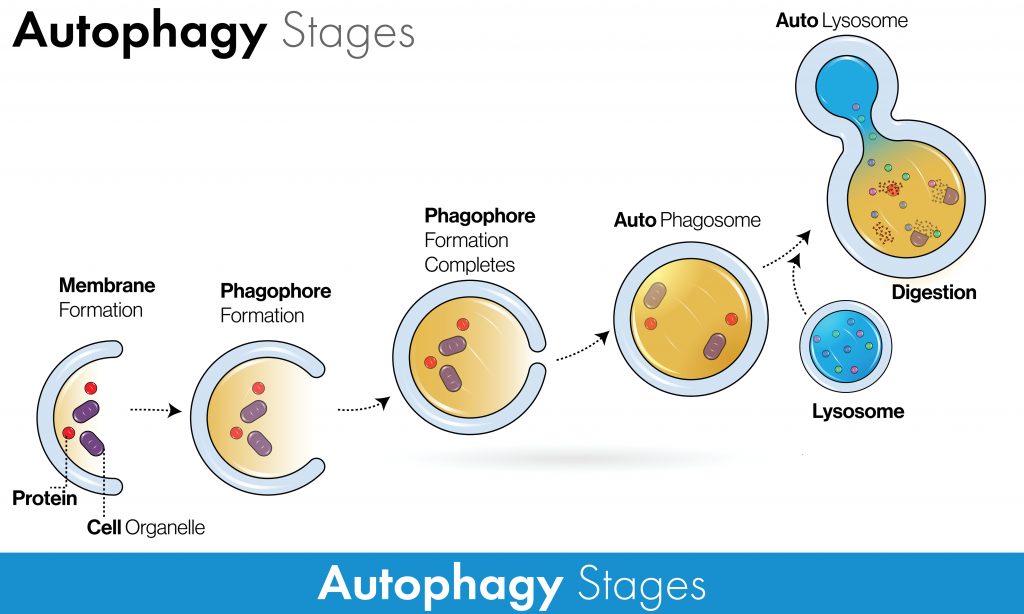
Macro-autophagie
La macro-autophagie comprend plusieurs étapes clés :
- Une membrane d’isolement, appelée « phagophore », commence à se former autour des composants sélectionnés ou non.
- Les bords du phagophore se dilatent et se ferment, formant une nouvelle structure appelée « autophagosome ».
- L’autophagosome fermé, chargé de composants, fusionne avec le « lysosome », l’usine de recyclage de la cellule, pour former un « autolysosome ». Il contient des enzymes appelées hydrolases lysosomales qui digèrent et dégradent son contenu.
- Ce processus génère des acides aminés et d’autres sous-produits de dégradation qui peuvent être recyclés et réutilisés pour la construction.
Micro-autophagie
Dans la micro-autophagie, les composants sélectionnés ou non sélectionnés sont directement absorbés par le lysosome lui-même en repliant la membrane lysosomale.
Autophagie médiée par les chaperons
Dans l’autophagie médiée par les chaperons, les composants sélectionnés sont déplacés à travers le lysosome dans un complexe avec des protéines chaperons, ce qui entraîne leur expansion et leur dégradation.
Quand l’autophagie est-elle déclenchée ?
Nos cellules maintiennent constamment à un faible niveau les processus d’autophagie, sélectifs et non sélectifs : on parle alors d’« autophagie basique ». Cependant, l’autophagie non sélective est fortement déclenchée lorsque l’organisme est confronté à divers stress et conditions physiologiques, comme le jeûne, l’hyperthermie ou l’hypoxie. L’autophagie sélective peut également être induite en réponse au stress : on parle alors d’« autophagie significative ».
Les principaux produits de l’autophagie sont des acides aminés dérivés de protéines cellulaires. L’autophagie s’installe très rapidement et survient avant que les sources d’énergie ne soient complètement épuisées. Par exemple, des souris privées de nourriture pendant 24 heures présentent une autophagie accrue dans de nombreux tissus, mais conservent suffisamment de lipides (le glycogène peut être consommé dès le premier jour). Il est donc peu probable que l’autophagie fournisse de l’énergie dans ces conditions. En effet, plusieurs études suggèrent que les acides aminés dérivés de l’autophagie sont utilisés pour synthétiser des protéines essentielles à l’adaptation à la famine. La restauration cellulaire des niveaux d’acides aminés réactive la protéine kinase sérine/thréonine mTORC1 et met fin à l’autophagie.
Le jeûne peut augmenter les niveaux d'autophagie
La question centrale est de savoir si les bénéfices observés sont liés à cette augmentation de l’autophagie ou s’il s’agit simplement d’une corrélation. Ainsi, en l’absence de réponses claires, l’erreur que nous commettons régulièrement est de vouloir jeûner suffisamment longtemps pour savoir combien de temps il faut jeûner pour induire une autophagie significative. Cependant, rappelons que l’autophagie joue plusieurs rôles. D’une part, la dégradation sélective des composants endommagés garantit l’intégrité cellulaire de manière permanente. D’autre part, la dégradation non sélective d’une partie du cytoplasme permet à la cellule de s’adapter et de survivre face au stress en attendant le retour à la normale.
La réponse au stress induit avant tout une autophagie non sélective pour l’adaptation et la survie cellulaire. Nous concluons, contrairement à ce que soutiennent fréquemment les spécialistes du jeûne, qu’il ne faut pas chercher à jeûner pour induire une autophagie significative (principalement non sélective). En revanche, il faut jeûner pour se prémunir contre toute altération de l’autophagie fondamentale (principalement sélective) au fil du temps, qui survient lorsque la cellule est nourrie. En effet, une déficience de l’autophagie sélective dite basique conduit à de nombreuses pathologies.
Différencier l'autophagie, l'apoptose et la nécrose
Cell death is fundamental for the proper execution of normal body processes. However, excessive cell death is involved in developing pathologies such as AIDS and neurodegenerative diseases. On the other hand, the capacity of cells to die favors the emergence of cancers. There are 3 forms of cell death: autophagy, apoptosis, and necrosis.
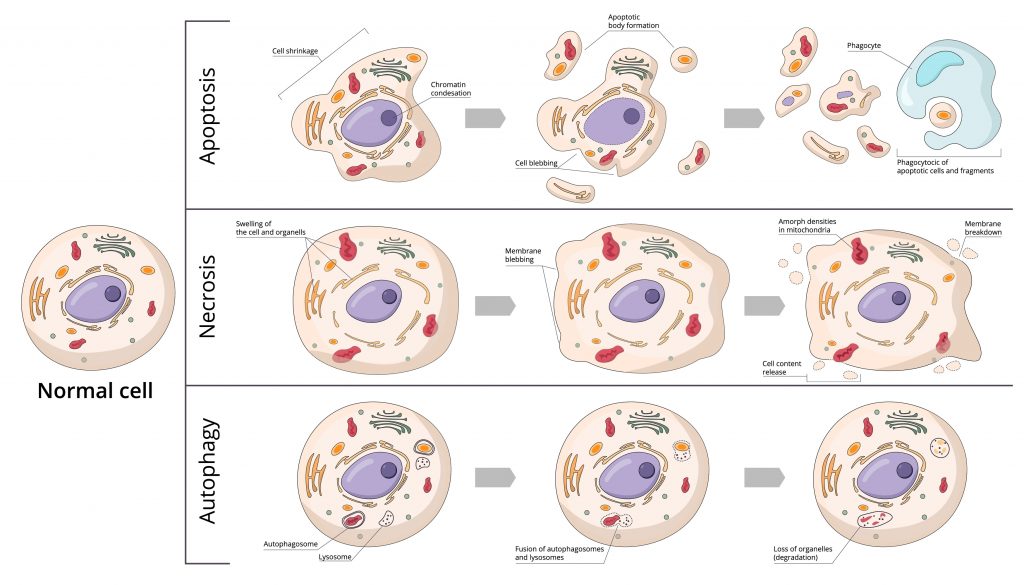
Autophagie
Il s’agit d’un processus de dégradation et de nettoyage au cours duquel les cellules détruisent leurs composants via la machinerie lysosomale et un processus de recyclage. Alors que l’apoptose remplit son rôle en démantelant les cellules endommagées ou indésirables, l’autophagie maintient l’homéostasie cellulaire grâce au recyclage sélectif des organites intracellulaires. Contrairement à l’apoptose, l’autophagie est peu ou pas associée aux phagocytes.
Cependant, dans certaines conditions, l’autophagie peut parfois aller jusqu’à la mort cellulaire lorsque les dommages intracellulaires sont trop importants et que l’apoptose est compromise. Ces mêmes contraintes peuvent stimuler l’apoptose et l’autophagie. On sait maintenant qu’il existe des échanges entre les voies apoptotique et autophagique, et des études ont montré que BCL2, un gène régulateur important de l’apoptose, est également un régulateur important de l’autophagie.
Apoptose
L’apoptose est une mort cellulaire programmée, dirigée par les gènes. Elle intervient dans l’élimination des cellules immunitaires incompétentes ou inutiles, ainsi que des cellules présentant des dommages irréparables à l’ADN. Elle comporte deux phases : la première phase est l’initiation de la mort cellulaire, et la seconde phase est l’élimination de la cellule mourante. L’élimination de la cellule mourante commence généralement avant la cellule elle-même et est complètement démantelée par une phagocytose spécialisée. Il s’agit donc d’un phénomène normal et nécessaire à la survie des organismes multicellulaires. Il est en équilibre constant avec la prolifération cellulaire.
La dérégulation de l’apoptose peut être à l’origine de nombreuses pathologies. Certaines sont liées à une inhibition de l’apoptose (cancer, syndromes lymphoprolifératifs, etc.), tandis que d’autres sont associées à une stimulation de ce phénomène (SIDA, maladies neurodégénératives, maladies auto-immunes, etc.). L’apoptose s’accompagne d’une réduction du volume cellulaire, d’une fragmentation de l’ADN, d’un saignement de la membrane plasmique et d’une absorption par les phagocytes.
Nécrose
Elle est considérée comme une forme passive et non programmée de mort cellulaire. La nécrose peut être causée par une diminution de l’apport sanguin provoquant une hypoxie suffisamment longue pour asphyxier les tissus, un traumatisme altérant la circulation sanguine, une infection bactérienne et/ou éventuellement fongique, un processus cancéreux ou des venins. La nécrose est donc un phénomène pathologique. Cependant, des données récentes suggèrent qu’elle pourrait également représenter une forme de mort cellulaire programmée dont l’activation peut avoir des conséquences importantes, comme l’induction d’une réponse inflammatoire. Elle s’accompagne d’une augmentation du volume cellulaire, d’un gonflement des organites, d’une rupture de la membrane plasmique et d’une perte de contenu intracellulaire.
L'autophagie dans la santé et la maladie
L’autophagie basique permet, comme nous l’avons vu, le nettoyage sélectif des composants intracellulaires endommagés ou des pathogènes invasifs. Par conséquent, son action en conditions normales protège la cellule contre les dommages à l’ADN, qui pourraient autrement conduire à la formation de tumeurs. Elle est considérée comme un facteur suppresseur de cancer.
Sans surprise, les données montrent que ce déficit basique d’autophagie est associé à la tumorigenèse (formation de tumeurs) et aux maladies neurodégénératives (maladies d’Alzheimer, de Parkinson, troubles hépatiques, sclérose latérale amyotrophique).
D’autre part, une autophagie basique élevée est observée dans plusieurs types de cancers, tels que les cancers du pancréas. Dans le traitement de ces cancers, l’inhibition de l’autophagie élevée par des traitements médicamenteux diminue la prolifération cellulaire et favorise la suppression tumorale. En biologie du cancer, l’autophagie est donc considérée comme jouant un double rôle dans la suppression tumorale, mais aussi dans le développement tumoral.
« L’autophagie joue un double rôle dans la suppression et le développement des tumeurs. »
Indeed, several studies indicate that autophagy promotes tumor survival and growth in advanced cancers. When tumors are exposed to extremely stressful conditions, including hypoxia and nutrient deprivation, autophagy helps cells overcome these stresses and obtain the large amounts of energy they need to promote their survival. Autophagy is thought to function as a tumor suppressor in non-tumor cells or in the early stages of tumor cell development. Still, conversely, it is thought to promote the survival of cancer cells once tumors are established.
Conclusion
Donc, finalement : est-il plutôt défavorable de jeûner pour induire l’autophagie lorsqu’on est déjà atteint d’un cancer ? La réponse ne peut pas se baser uniquement sur le processus autophagique, car lors d’un jeûne, une diversité d’autres processus se produisent parallèlement à l’essor de l’autophagie non sélective. En pratique, nous voyons des patients atteints de cancer expérimenter des jeûnes longs et obtenir des résultats miraculeux, parfois catastrophiques.
Par conséquent, on ne peut pas affirmer que le jeûne prolongé (plus de 20 jours) soit la solution la plus appropriée pour un cancer avancé. D’une part, l’autophagie importante induite permettra également aux cellules cancéreuses et non cancéreuses de s’adapter et de survivre. D’autre part, si les autres processus induits lors d’un jeûne long ne dégradent pas suffisamment la grande majorité de la tumeur, alors l’augmentation des facteurs de croissance qui a lieu lors de la reprise de l’alimentation. Et, l’augmentation de notre sensibilité à ces facteurs (d’autant plus importante après un jeûne long) nourrira les cellules cancéreuses restantes et favorisera leur développement. Ainsi, pour les cancers avancés, on pourrait supposer qu’il serait plus prudent et intéressant d’opter pour un régime cétogène n’induisant pas d’autophagie importante et de faire régulièrement des jeûnes courts (jeûnes secs inclus).
Si vous souhaitez en savoir plus sur le jeûne, n’hésitez pas à jeter un œil sur le site dédié : Jeûne & Sens
Intéressé par le jeûne ? Consultez nos autres articles sur le jeûne :